超大孔填料在病毒样颗粒(VLP)疫苗纯化中的应用
VLP作为一个更具前景的载体工具,被广泛应用于基因治疗、疫苗研发和诊断等领域。相对于传统疫苗,VLP疫苗的安全性更高、免疫效果更好。在VLP疫苗的大规模生产中,下游层析工艺对最终产品的稳定性、安全性及有效性起到至关重要的作用。
VLP的特别之处
VLP(Virus Like Particle),病毒样颗粒,来源于病毒的外层衣壳蛋白,由一种或者多种衣壳蛋白组分自动组装形成的纳米级别的微小颗粒。VLP颗粒由病毒衣壳蛋白自组装而成,不含有病毒基因组,此特殊的空间结构能强烈地刺激人体的免疫系统,有效地诱导人体产生免疫保护反应。其优势如下:
安全性高:VLP不含复制酶和编码病毒结构蛋白的核酸,缺乏复制能力,不会传染,安全性有保障;
免疫效果好:VLP作为大小在40 - 200nm的抗原,可迅速排入淋巴结(LNs),并与抗原提呈细胞(APCs)和B细胞相互作用,有效刺激B细胞和T细胞反应。
表达系统多样性:大肠杆菌、酵母、哺乳动物细胞、昆虫细胞和植物等多种表达体系可用于表达VLP。
技术成熟,已经商业化:据文献资料显示,目前已上市的基于VLP病毒样颗粒的疫苗有包括2价、4价、9价的人乳头瘤病毒(HPV)疫苗、乙型肝炎病毒(HBV)疫苗、戊型肝炎病毒(HEV)疫苗以及疟疾疫苗。更多基于VLP的候选疫苗正在进行临床前和临床试验。
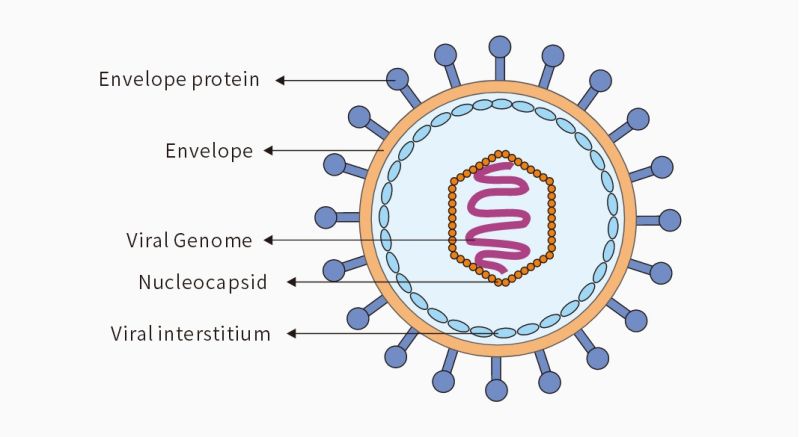
VLP的包膜结构
VLP主要分为eVLP和非包膜VLP,两者最大的区别就是在蛋白质衣壳外是否有一层包膜。
非包膜VLP:由单个或多个衣壳蛋白组成的结构相对简单的 VLP,可以在原核和低级真核系统中表达,例如:戊肝病毒、HPV病毒、手足口病毒。
包膜VLP(eVLP):以矩阵形式包裹在来源于宿主的含有糖蛋白的脂膜中,结构复杂,构建难度大,但可设计性更强。通常在真核表达系统表达,需要共表达几种结构蛋白用于细胞内的自组装过程。例如:乙肝病毒、流感病毒、冠状病毒。
VLP疫苗纯化中的挑战
VLP疫苗尽管优势明显,市场潜力巨大,但是目前仍然存在某些方面的局限及困难,尤其是产品纯化方面,VLP 的宿主细胞衍生膜能够整合抗原和佐剂,与此同时,也存在多种与工艺相关的宿主细胞杂质,产品收率低(特别是包膜VLP),加上缩短上市时间及高昂的开发成本等压力,都在一定程度上导致了工艺开发的不足,为下游工艺开发带来了极大的挑战。
目前市场上已有的纯化工艺,大都采用普通的层析介质,或多或少都有一定的局限性。
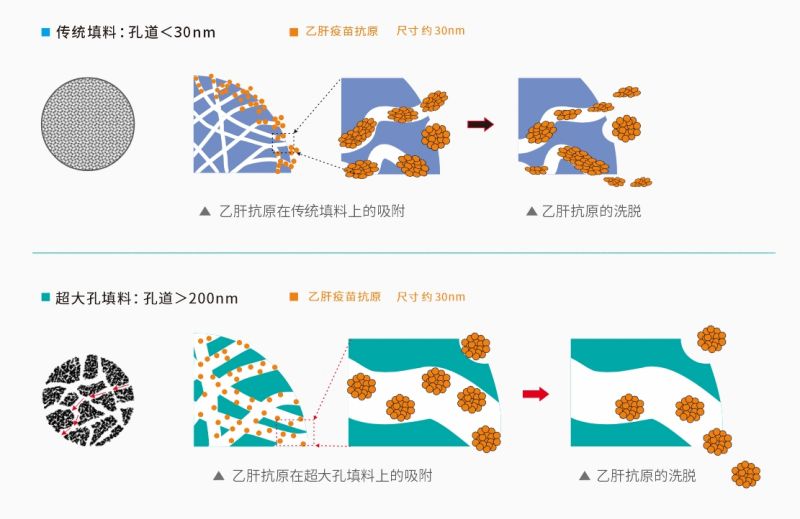
与其他生物分子相比,VLP病毒颗粒最大的特点在于其多聚亚基的大颗粒结构,且分子尺寸较大(直径20~800nm),普通的琼脂糖微球和聚合物微球孔径较小,病毒颗粒不能有效的进入微球内部而导致结合载量及其低,同时狭窄的孔径会导致其以扩散的方式通过,传至速度慢,处理量低,耗时长,且会破坏病毒颗粒的结构使其解聚,活性降低,从而影响回收率。
科诺赛经过充分的市场调研,聚焦VLP纯化中的难点,结合自有的超大孔色谱分离技术(孔径大于200nm),提出了VLP纯化的解决方案,并成功地实践应用,为客户解决了问题。
VLP疫苗纯化推荐方案
纯化策略的主线 - 澄清、捕获、纯化和精纯。
在收获和裂解细胞后,为了确保去除污染的细胞碎片和聚集体,需要进行澄清。为了获得完整和更纯净的VLP,需要再进一步分离纯化。
病毒样颗粒 VLP的下游纯化工艺因表达体系的不同,存在不同的纯化策略,其中Crysto Shell 700 / 400复合模式层析填料和MoSphere 50V Q / DEAE超大孔层析介质,因其独特的结构特点在 VLP 纯化工艺开发中占据优势地位。
VLP粒径较大,优先考虑Crysto Shell 700,VLP粒径较小,优先考虑Crysto shell 400,具体需要根据试验结果平衡收率和纯度来综合考虑。
而在精纯步骤,由于病毒颗粒较大,MoSphere 50V Q / DEAE超大孔层析介质,是最佳选择。
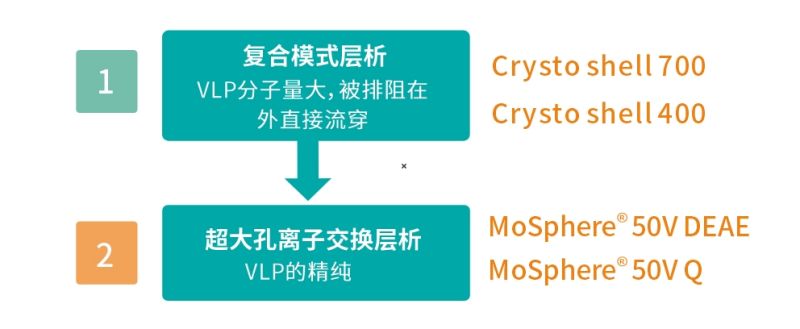
VLP纯化 方案一
第①步 复合模式层析纯化:
使用Crysto Shell 700 / 400(阴离子交换与疏水双重功能)复合模式层析介质,吸附宿主细胞杂质,VLP分子量大,排阻在外直接流穿,此步骤可以去除 85% 的宿主蛋白。
PS:Crysto Shell 相比 Capto Core 孔径更小,可确保回收率。
第②步 离子交换层析纯化:
使用MoSphere 50V Q / DEAE超大孔阴离子交换层析介质,进行精纯。
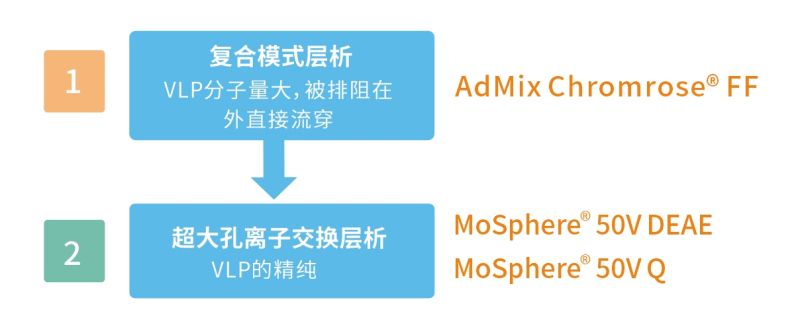
VLP纯化 方案二
第①步 复合模式层析纯化:
使用AdMix Chromrose FF(阴离子交换与疏水双重功能)复合模式层析介质,吸附宿主细胞杂质,VLP分子大,排阻在外直接流穿,此步骤可以去除 80% 的宿主蛋白。(VLP粒径>80nm适用)
第②步 离子交换层析纯化:
使用MoSphere 50V Q / DEAE超大孔阴离子交换层析介质,进行精纯。
PS:此方案较【方案一】成本更低,可作为节省成本的替代方案。
包膜VLP纯化应用案例
项目背景: 客户样品为有包膜的病毒抗原VLP疫苗,筛选了市场上多家填料均无法满足要求,只有某进口品牌的强阴离子介质能够满足其结合要求,没有流穿,但载量较低。 客户更换为科诺赛超大孔离子交换介质后,在高盐的情况下,不仅结合性好,载量也有所提升,完全能够实现填料国产化替代。
科诺赛产品:MoSphere 50V Q 超大孔阴离子交换介质
项目进展:中试 。
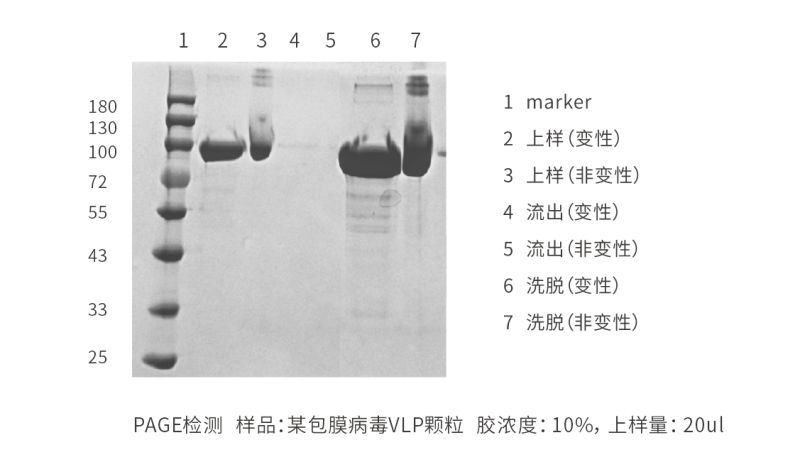
测试结果:
采用科诺赛 MoSphere 50V Q 超大孔离子交换介质,在高盐条件下上样,没有流穿出现。
VLP疫苗纯化的方案不止以上这几种,来自同一家族病毒的VLP可能具有复杂的表面特性。例如,不同毒株的流感VLP在表面抗原上有差异,这就需要因地制宜地调整纯化策略。
总的来说,科诺赛的MoSphere 50 系列超大孔层析填料,在病毒颗粒(VLP)疫苗下游分离纯化工艺中是必不可少的、最有效的分离载体之一。
匹配市场需求的产品才有价值
科诺赛的超大孔填料,已经被广泛应用于病毒、VLP、AAV载体、质粒、外泌体、mRNA及超大蛋白分子的分离纯化中,并且充分显示出了其在纯化方面的优越性,成功了帮助客户解决了一个个纯化难题,切实地帮助客户实现降本增效。






